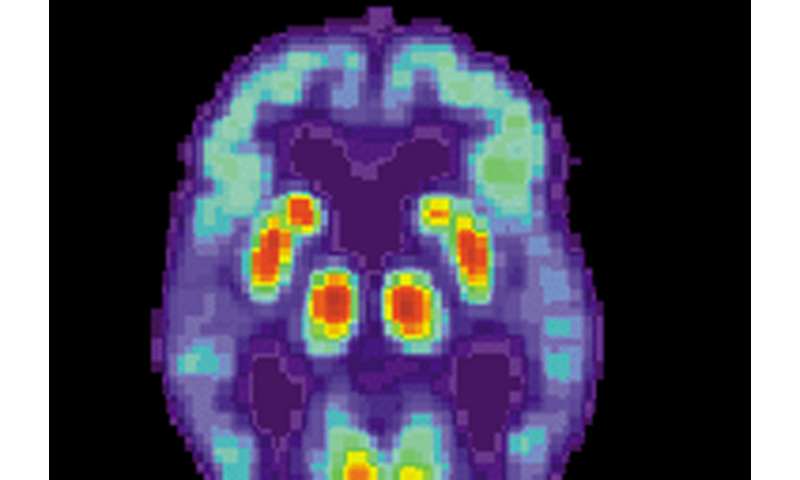
Gehirn-Bildgebung des pathologischen tau-proteins “Kabelsalat” zuverlässig prognostiziert die Lage der zukünftigen Gehirn-Atrophie bei Alzheimer-Patienten ein Jahr oder mehr im Voraus, entsprechend einer neuen Studie durch Wissenschaftler an der UC San Francisco Speicher und Aging-Center. Im Gegensatz dazu, die Lage der amyloid-plaques”, die im Mittelpunkt der Alzheimer-Forschung und Arzneimittel-Entwicklung für Jahrzehnte, wurde festgestellt, dass der kleine utility in der Vorhersage, wie Schaden würde entfalten, wie die Krankheit Fortgeschritten ist.
Die Ergebnisse, veröffentlicht 1. Januar 2020 in Science Translational Medicine, Unterstützung von Forschern von der wachsenden Erkenntnis, dass die tau-Laufwerke Gehirn-degeneration bei der Alzheimer-Krankheit mehr direkt als amyloid-protein, und zeigt gleichzeitig auf, wie das Potenzial der kürzlich entwickelten tau-basiert PET (Positronen-emissions-Tomographie) – Bildgebung des Gehirns-Technologie zur Beschleunigung der Alzheimer-Krankheit klinischen Studien und die Verbesserung der individuelle Patientenversorgung.
“Das Spiel zwischen der Ausbreitung der tau-und was passiert mit dem Gehirn im folgenden Jahr war wirklich Auffällig”, sagte der Neurologe Gil Rabinovici, MD, Edward Fein und Pearl Landrith Distinguished Professor in Speicher-und Aging und Leiter der PET-imaging-Programm an der UCSF Speicher und Aging-Center. “Tau-PET-Bildgebung vorhergesagt, nicht nur, wie viel Atrophie, wir würden sehen, aber auch, wo es geschehen würde. Diese Vorhersagen waren viel mächtiger als alles, was wir konnten tun, mit anderen imaging-tools, und fügen Sie Beweise dafür, dass tau ein wichtiger Treiber ist die Krankheit.”
Interesse an den Tau Wächst, wie Amyloid-Basierte Therapien Stolpern
Alzheimer-Forscher haben lange darüber diskutiert, die relative Bedeutung von amyloid-plaques und tau Kabelgewirr—zwei Arten von fehlgefalteten protein-Clustern gesehen, die in postmortem-Studien von Patienten Gehirne, die beiden ersten identifiziert durch Alois Alzheimer im frühen 20sten Jahrhundert. Seit Jahrzehnten, die “amyloid-camp” hat dominiert, was zu mehreren high-profile-Bemühungen zu verlangsamen Alzheimer mit amyloid-targeting-Drogen, alle mit enttäuschenden oder gemischte Ergebnisse.
Viele Forscher sind jetzt einen zweiten Blick auf tau-protein, einmal entlassen, wie einfach ein “Grabstein” – Kennzeichnung absterbenden Zellen, und untersucht, ob sich tau kann in der Tat eine wichtige biologische Fahrer der Krankheit. Im Gegensatz zu amyloid, die sich weit über das Gehirn, manchmal sogar in den Leuten mit keine Symptome, Autopsien von Alzheimer-Patienten haben gezeigt, dass tau konzentriert sich genau dort, wo Gehirn-Atrophie ist die schwerste, und in Orten, die erklären helfen, Unterschiede in der Patienten-Symptome (in der Sprache-Verwandte Gebiete vs. memory-related Regionen, zum Beispiel).
“Niemand zweifelt daran, dass amyloid eine Rolle spielt bei der Alzheimer-Krankheit, sondern mehr und mehr tau Erkenntnisse beginnt sich zu verschieben, wie die Leute denken, was ist das eigentlich treibende der Krankheit”, erklärt Renaud, La Joie, Ph. D., ein Postdoktorand in Rabinovici In-Vivo-Molecular Neuroimaging-Labor und Erstautor der neuen Studie. “Still, schaut auf post-mortem-Hirngewebe, ist es schwierig zu beweisen, dass tau-Verwicklungen verursachen, Gehirn-degeneration und nicht die andere Weise herum. Einer unserer Gruppe die wichtigsten Ziele war die Entwicklung nicht-invasiver brain-imaging-tools, würde lassen Sie uns sehen, ob die Lage des tau-Ablagerungen im Frühstadium der Krankheit vorhersagt, später Gehirn-degeneration.”
Tau-PET-Scans Vorherzusagen Standorte der Zukünftigen Gehirn-Atrophie bei Einzelnen Patienten
Trotz anfänglicher Bedenken, dass die tau gar nicht zu Messen, im lebenden Gehirn die Wissenschaftler, die vor kurzem entwickelt eine injizierbare Molekül namens flortaucipir—derzeit “under review” durch die FDA—die Bindung zu falsch gefalteten tau im Gehirn und strahlt eine milde radioaktive signal kann abgeholt werden durch PET-scans.
Rabinovici und Mitarbeiter William Jagust, MD, von der UC Berkeley und Lawrence Berkeley National Laboratory, wurde unter den ersten zu verabschieden tau-PET-Bildgebung zur Untersuchung der Verteilung von tau-Verwicklungen in der normal alternden Gehirns und in einer kleineren cross-sectional-Studie von Alzheimer Patienten. Ihre neue Studie ist der erste Versuch zu testen, ob tau-levels in Alzheimer-Patienten kann Vorhersagen, Gehirn-degeneration.
La Joie rekrutiert 32 Teilnehmer mit frühen klinischen Stadium der Alzheimer-Krankheit durch die UCSF Speicher und Aging-Center, von denen alle erhaltenen PET-scans mit zwei verschiedenen tracern zu Messen Ebenen von amyloid-protein und tau-protein im Gehirn. Die Teilnehmer erhielten auch MRI-scans zu Messen Gehirns, die strukturelle Integrität, sowohl zu Beginn der Studie, und wieder in der follow-up-Besuche ein bis zwei Jahre später.
Die Forscher fanden, dass Gesamt-tau-Stufen die Teilnehmer den Gehirnen zu Beginn der Studie vorhergesagt, wie viel degeneration auftreten würde, durch die Zeit, Ihre follow-up-Besuch (im Durchschnitt 15 Monate später). Darüber hinaus, lokale Muster von tau-Ablagerungen vorhergesagt nachfolgenden Atrophie in den gleichen Orten mit mehr als 40 Prozent Genauigkeit. Im Gegensatz dazu baseline-amyloid-PET-scans richtig vorhergesagt haben, nur 3 Prozent der zukünftigen Gehirn-degeneration.
“Zu sehen, dass tau-Ablagerungen prognostiziert, wo die degeneration auftreten, unterstützt unsere Hypothese, dass tau ist ein wichtiger Treiber der neurodegeneration in Alzheimer’ s disease,” La Joie sagte.
Insbesondere die PET-scans zeigten, dass die jüngeren Teilnehmer der Studie hatten insgesamt höheren Ebenen von tau im Gehirn, sowie eine stärkere Verbindung zwischen baseline-tau und die anschließende Gehirn Atrophie, im Vergleich zu älteren Teilnehmern. Dies deutet darauf hin, dass andere Faktoren—wahrscheinlich andere abnorme Proteine oder Gefäßverletzungen—spielen kann eine größere Rolle in der late-onset Alzheimer-Krankheit, die Forscher sagen.
Fähigkeit, Vorherzusagen, Gehirn-Atrophie ein “Wertvolles Präzision-Medizin-Tool”
Die Ergebnisse bestätigen die Hoffnungen, dass die tau-targeting-Medikamente, die derzeit unter Studie, die an der UCSF Speicher und Aging-Center und anderswo können bieten klinische Vorteile für die Patienten durch die Blockierung dieser Schlüssel-Treiber der neurodegeneration in der Krankheit. Zur gleichen Zeit, die Fähigkeit zu verwenden, tau-PET voraussagen, später Gehirn-degeneration ermöglichen könnte, mehr personalisierte Demenz die Pflege und die Geschwindigkeit, die Laufenden klinischen Studien, sagen die Autoren.
“Eines der ersten Dinge, die Menschen wollen wissen, wenn Sie hören, eine Diagnose der Alzheimer-Krankheit ist einfach, was die Zukunft für sich oder Ihre lieben. Es wird eine lange verblassen der Erinnerung, oder eine schnelle Abstieg in die Demenz? Wie lange wird der patient in der Lage sein, selbständig zu Leben? Sie verlieren die Fähigkeit zu sprechen oder sich um sich auf Ihre eigenen? Diese Fragen können wir derzeit nicht beantworten, außer in den Allgemeinen Geschäftsbedingungen,” Rabinovici sagte. “Jetzt, zum ersten mal, dieses tool könnten wir uns den Patienten ein Gefühl von dem, was zu erwarten, dass durch die Enthüllung der biologische Prozess zugrunde liegenden Ihre Krankheit.”
Rabinovici und sein team erwarten auch, dass die Fähigkeit, voraussagen, Zukunft, Gehirn-Atrophie basierend auf tau-PET-Bildgebung ermöglichen Alzheimer klinischen Studien zu schnell beurteilen, ob eine experimentelle Behandlung verändern können, die bestimmte Trajektorie vorhergesagt, die bei einzelnen Patienten, die derzeit nicht durch die große Variabilität in, wie die Krankheit fortschreitet, von Individuum zu Individuum. Solche Erkenntnisse könnten es möglich machen, die Dosis anpassen oder wechseln Sie zu einer anderen experimentellen Verbindung, wenn die erste Behandlung nicht beeinträchtigt tau Ebenen oder änderung eines Patienten die vorhergesagte Trajektorie des Gehirns Atrophie.