Forscher der TU München arbeiten an einer Methode, miteiner Gabe gleich drei Wirkstoffe zu verabreichen, die zu festen Zeitpunktennacheinander freigesetzt werden. Die Gruppe um Professor Oliver Lieleg nutztdazu die Eigenschaften von künstlicher DNA.
Dass Patienten mehrere Wirkstoffeeinnehmen müssen, zu unterschiedlichen Zeiten, ist nichts Ungewöhnliches. Auchdass mehrere Wirkstoffe in Kombination in einem Medikament gegeben werdenkönnen, ist wenig überraschend. Neu allerdings ist eine Methode, mit der sehrspezifisch derzeit bis zu drei verschiedene Wirkstoffe in einer Gabeverabreicht werden können, die passgenau nacheinander in vorgegebenerReihenfolge und zu vorgegebenem Zeitpunkt freigesetzt werden.
Der Professor für BiomechanikOliver Lieleg an der Munich Schoolof BioEngineering an der TechnischenUniversität München und seine Doktorandin Ceren Kimna haben jetztdie Ergebnisse ihrer Arbeit an dem neuentwickelten Verfahren veröffentlicht (Engineering an orchestrated release avalanchefrom hydrogels using DNA-nanotechnology): Sie verwenden dazu eine Kombination aus Hydrogelen, künstlicher DNA undNanopartikeln. „So könnte zum Beispiel eine Salbe, die auf eine Operationswundeaufgetragen wird, Schmerzmittel, Entzündungshemmer und abschwellend wirkendesMittel nacheinander freisetzen“, erklärt Lieleg das Prinzip. HerkömmlichePräparate, die ihre Wirkstoffe retardiert, also verzögert freisetzen, könnten imGegensatz zum Verfahren der Münchener nicht garantieren, „dass nicht zeitweisemehrere Wirkstoffe gleichzeitig in den Organismus gelangen“, sagt derProfessor.
Silber-,Eisenoxid- und Gold-Partikel im Modellversuch
In den Arbeiten von Kimna wurdezunächst das Prinzip getestet. Dazu verwendeten die Forscher Nanopartikel ausSilber, Eisenoxid und Gold, die sich spezifisch spektroskopisch nachweisenließen. Die Partikel betteten sie in ein Hydrogel ein. Als Steuerungselement derWirkstofffreigabe nutzten die Forscher künstliche DNA und deren Eigenschaft,genau bestimmen zu können, wie stark und auf welche Weise sich deren Abschnitte miteinander verbinden.
So konstruierten dieWissenschaftler DNA-Stränge, die mit den Silberpartikeln komplexierten undeinen großen Teilchen-Cluster bildeten. Dieser war so groß, dass er sich in demHydrogel nicht bewegen konnte. Die Zugabe von Kochsalzlösung initiierte dann dieAblösung der Partikel von der DNA, die sich dann zur Geloberfläche bewegten.„Da die Kochsalzlösung ungefähr denselben Salzgehalt hat wie der menschlicheKörper, konnten wir so simulieren, dass die Wirkstoffe erst bei Anwendung desPräparats frei werden“, sagt Kimna.
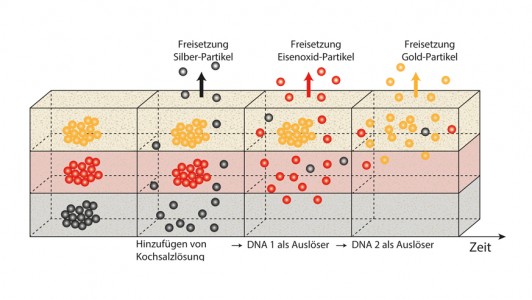
Als zweite „Schicht“ sollten in dem Modellversuch die Eisenoxid-Partikel freigesetzt werden. Diese waren durch zwei Arten von DNA verbunden, wobei die eine an einem Ende mit den Partikeln verbunden war während die andere DNA die Abschnitte miteinander verband. Diese Verbindung ist von der Salzkonzentration unabhängig. Die in der ersten Schicht von den Silberpartikeln freigesetzten DNA-Stücke verdrängen schließlich die Verbindungs-DNA und setzen so zeitlich nach dem Silber das Eisenoxid frei.
In der dritten Phase verdrängt wiederum die freigesetzte Verbindungs-DNA der Eisenoxid-Schicht nun spezifisch die Verbindungs-DNA der Gold-Phase, welches als dritter Modell-Wirkstoff zeitlich als letztes freigesetzt wird.
Quelle: Den ganzen Artikel lesen








