Wissenschaftler Sanford Burnham Prebys haben festgestellt, dass die lang gesuchte Struktur eine wesentliche Blut-protein: vitronectin. Die Kenntnis der Proteinstruktur—ein Fortschritt, ermöglicht rational drug design ” —könnte dazu führen, Arzneimittel, die töten multi-drug-resistenten Bakterien, die halt Krebs, Metastasen, Behandlung der altersbedingten Makula-degeneration (AMD) und mehr. Die Studie wurde veröffentlicht in der Wissenschaft Fortschritte.
“Für Jahrzehnte haben Wissenschaftler spekuliert über die Form der vitronectin, aber niemand hatte eine richtige Antwort”, sagt Francesca, Marassi, Ph. D., senior-Autor der Studie und professor an der Sanford Burnham Prebys’ NGI-gekennzeichneten Krebs-Mitte. “Unsere Ergebnisse bieten eine Blaupause für das Verständnis und die Ausrichtung dieser wichtigen menschlichen proteins.”
Da vitronectin Entdeckung in den 1960er Jahren, Wissenschaftler erkannt, dass das protein einen wichtigen Angriffspunkt und versucht, zu entziffern, seine komplexe Struktur. Das protein reguliert viele grundlegende Prozesse wie Blutgerinnung, Immunität, Gewebe-Entwicklung und die zelladhäsion. Wenn diese Funktionen sind gestört, Krankheiten können entstehen: Tödliche Metastasierung tritt auf, wenn Krebszellen die Fähigkeit erlangen, sich durch den Körper, und Krankheitserreger wie Y. pestis (Pest), H. influenzae (Lungenentzündung, Hirnhautentzündung), N. gonorrhoeae (Gonorrhoe) und H. pylori (Magengeschwüre), hijack vitronectin Entdeckung zu entgehen, indem Sie unser Immunsystem. Jedoch, ohne eine 3D-Struktur, Verständnis der protein die genaue Funktion im Körper und die Fähigkeit, design-Medikamente, die blockieren oder verstärken diese Funktion beschränkt waren.
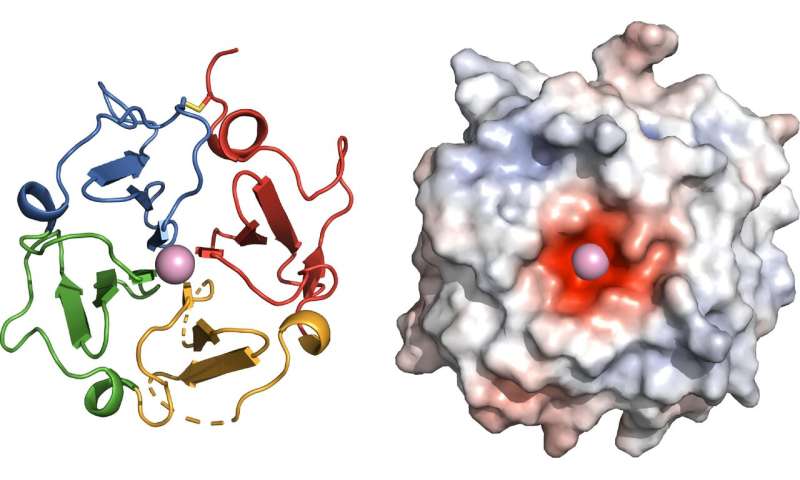
Zur Visualisierung der protein-Struktur, Marassi und Ihr team analysierten evolutionären Hinweise und wandte sich dann zu Röntgen-und Magnetresonanztomographie, MRI-Technologie. Die Forscher fanden, dass die funktionelle Seite von vitronectin bildet eine vier-Blatt-propeller mit einem negativ geladenen center, das calcium bindet. Hier offenbarte sich die Bindungsstelle des proteins Ail, die Y. pestis-Bakterien verwenden zu entführen vitronectin und entziehen das Immunsystem—eine wichtige Erkenntnis für die Antibiotika Arzneimittelentwicklung in der Veranstaltung plagen wird, die gegen Antibiotika resistent oder wird immer offensiver.
“Jetzt sehen wir, warum wir vitronectin hat so viele “Arbeitsplätze” in den Körper”, erklärt Marassi. “Der propeller dient als Drehscheibe für mehrere biologische Aktivitäten. Das protein insgesamt die Form und die negativ geladenen center bieten zusätzliche Einblicke über seine Cholesterin-und Kalzium-bindende Eigenschaften.”
“Die vielen Gesichter von vitronectin weiter zu überraschen”, sagt Erkki Ruoslahti, M. D., Ph. D., distinguished professor an der Sanford Burnham Prebys, die entdeckt, die protein-Klebstoff Eigenschaften und nannten es “vitronectin’, basierend auf seiner Fähigkeit, halten, um die Oberflächen des Glases. “Die erste Funktion zugeordnet vitronectin wurde, dass die Zellen in unserem Blut und Gewebe zu befestigen es, aber es hat sich da herausgestellt haben viele andere Funktionen. Der vitronectin-Struktur, die das Marassi-team von berichten ist ein wichtiger Meilenstein. Sie zeigen, dass die Bakterien, die die Ursache der Pest binden von vitronectin an einer Stelle Verschieden von der, die bisher bekannt für die Zell-Anhaftung, was darauf hindeutet, dass Bakterien vitronectin als Brücke zu binden menschlichen Wirtszellen und fördern deren infektiöse Kräfte.”
Nachdem die Struktur von vitronectin in der hand ist bereits enthüllt neue Einblicke in menschliche Krankheit. Mit diesen Informationen, Marassi gemacht, die Verbindung, die die Form von vitronectin korreliert mit seinem bekannten Engagement in AMD, ein Zustand, gekennzeichnet durch fortschreitenden Verlust der Sehkraft.








