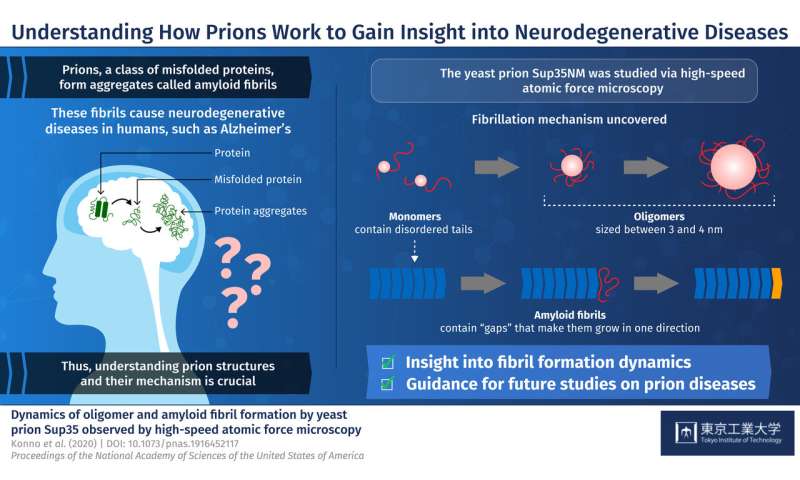
Prionen sind eine Klasse von fehlgefalteten Proteinen, bilden Aggregate, sogenannte amyloid-Fibrillen. Diese Aggregate sind die wichtigsten Täter hinter schweren Säuger-und neurodegenerativen Erkrankungen wie Alzheimer. Was macht Sie so tödlich ist, dass Sie in der Lage sind, die übertragung Ihrer fehlerhaften Konformation zu ansonsten gesunden Proteinen, was zu einem Ungleichgewicht in der zellulären Funktion. Derzeit gibt es keine wirksamen Behandlungen für die tödliche Prionen-Krankheiten, vor allem, weil das Studium säugetier-Prionen ist eine Herausforderung. So haben die Wissenschaftler wandte sich an das Studium Prionen in weniger komplexen Organismen wie Hefe, die mehr Einblick über die säugetier-Prionen. Hefe Prionen, wie das protein Sup35NM, sind auch bekannt, zu bilden amyloid-Fibrillen. Aber der Prozess, durch den die einzelnen Sup35NM Moleküle, sogenannte Monomere, bilden amyloid-Fibrillen ist noch nicht verstanden. Darüber hinaus Sup35NM Monomere bilden manchmal kleinere Strukturen genannt oligomere—ein weiterer Prozess, bleibt unklar. Zu beleuchten, die prion-Erkrankungen, ist es wichtig zu verstehen, die genauen details, wie amyloid-Fibrillen gebildet werden, die von Prionen.
In einer neuen Studie, die im PNASdie Forscher vom Tokio Institute of Technology und der Kanazawa-Universität unter der Leitung von Prof Hideki Taguchi festgelegt, um tiefer in prion Strukturen und deren Mechanismen. Sie verwendet eine moderne Mikroskopie-Technik namens high-speed atomic force microscopy (HS-AFM), entwickelt von Dr. Toshio Ando an der Kanazawa-Universität zu visualisieren, die Bildung von Sup35NM amyloid-Fibrillen in Echtzeit. Prof Taguchi, erklärt: “Bisherige Studien verwendeten Methoden nicht erlauben die gleichzeitige, hochauflösende Bewertung der Strukturen und der Dynamik, die in Sup35NM oligomerization und Kammerflimmern. Um diese Einschränkung zu überwinden, verwendeten wir HS-AFM, das ermöglicht die direkte Visualisierung der protein-Moleküle, die sich in dynamischen action in hoher Auflösung.”
Zu Beginn werden die Forscher analysierten Sup35NM Monomere mit HS-AFM. Ihre Analyse zeigte, dass Sup35NM Moleküle enthalten eine globuläre Struktur mit zwei sehr flexiblen Schwanz-ähnliche Strukturen. Dann, zu beobachten, die oligomere Formen von Sup35NM, Monomere wurden inkubiert in einer denaturierenden Lösung unter kontrollierten Bedingungen, die, in ein paar Stunden, führte zur Bildung von oligomeren. Weitere HS-AFM-Analysen ergab, die genaue Größe dieser oligomere—ein maximum von 3-4 nm, wächst nicht mehr als das. So haben die Wissenschaftler abgeleitet, dass diese Größe könnte eine inhärente Eigenschaft von oligomeren unter diesen Bedingungen.
Die Forscher wechselte dann zum Studium der Härchen Formen der Sup35NM. Im Gegensatz zu oligomere, Fibrillen benötigt viel längere Inkubationszeit zu bilden, in der Regel zwei bis drei Tage. Darüber hinaus beobachteten die Forscher, dass die Härchen länglich glatt, ohne die Befestigung des oligomers. Diese Ergebnisse zeigten, dass Sup35NM oligomere sind nicht Voraussetzung für die Bildung von amyloid-Fibrillen führt die Wissenschaftler zu dem Schluss, dass oligomere könnte tatsächlich besitzen zelluläre Funktionen, unterscheiden sich von denen der Sup35NM.
Schließlich untersuchten die Forscher ein Interessantes Phänomen, wo oligomere und Härchen Strukturen scheinen zu pflegen, ein interspatial Abstand oder “Lücke.” Sie beobachteten, dass der Stamm der Fibrillen hat eine starre Struktur, stößt die oligomere aus den Seiten. Inzwischen die Lücke zwischen der Spitze der Härchen und in der Nähe oligomere ist weniger ausgeprägt, weil die Spitze nicht so starre Strukturen. Dies half, die Wissenschaftler verstehen, warum Sup35NM amyloid-Fibrillen wachsen immer in gerader Richtung, ohne dabei irgendwelche Zweige.
In Summe sind diese Ergebnisse liefern einen detaillierten Bericht in die strukturelle und funktionelle Eigenschaften des Hefe-Prionen in Ihre Monomere, oligomere und Härchen bildet. “Unsere HS-AFM-Beobachtungen von Sup35NM enthüllte features von Sup35NM Dynamik, die Bereitstellung von mechanistischen Einblick in die amyloid-fibrillenbildung,” schließt Prof Taguchi.








